Estirpes de ratones noqueados para descifrar sus genes
Los hallazgos de Mario R. Capecchi, Martin J. Evans y Oliver Smithies se han convertido en métodos habituales de laboratorio
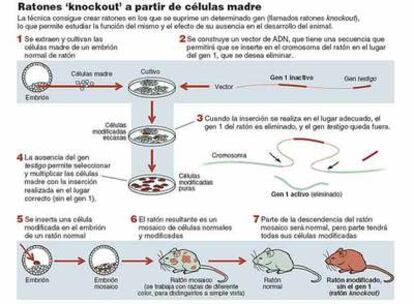
E l Proyecto Genoma ha desvelado que el hombre, al igual que otros mamíferos, posee entre 20.000 y 25.000 genes diferentes. Un nuevo reto es comprender la función de cada uno de ellos. Ser capaces de generar un ratón knockout en el que un determinado gen es suprimido y ver cómo esto afecta a su fisiología supone una herramienta muy valiosa. Además, como muchas enfermedades hereditarias son debidas a mutaciones que hacen que la proteína codificada por el gen mutado deje de funcionar correctamente, un ratón knockout de dicho gen constituye un modelo animal de la enfermedad para estudiar por qué la pérdida de función del gen acaba desembocando en la patología y para ensayar posibles nuevas terapias. Los científicos Mario R. Capecchi [EE UU], Martin J. Evans [Reino Unido] y Oliver Smithies [EE UU] han recibido el Premio Nobel de Fisiología o Medicina precisamente por el descubrimiento del procedimiento para generar estirpes de ratones en las que un determinado gen es modificado gracias al uso de células madre embrionarias.
En la actualidad, se dispone de versiones de ratones 'knockout' de unos 10.000 genes
Evans fue pionero en conocer las propiedades de las células madre
Las colecciones de estirpes mutantes de organismos más simples, tales como bacterias, levaduras, o incluso insectos como la mosca del vinagre, que tienen ciclos vitales más cortos y genomas mucho más pequeños que los de los mamíferos, son una herramienta clave y clásica en biología. En estos organismos más simples es posible introducir mutaciones genéticas al azar mediante radiaciones o sustancias químicas que alteran el ADN para después seleccionar estirpes individuales y, finalmente, identificar la mutación concreta incorporada en cada estirpe.
En el caso de las bacterias, que tienen un ciclo vital de minutos o de horas, la selección de una estirpe entre millones se realiza en una pequeña placa de laboratorio. En el caso de la mosca del vinagre, que tiene un ciclo vital de tres semanas, la selección de entre cientos de estirpes se realiza en un tubo de vidrio. Un proceso similar en mamíferos de laboratorio como el ratón, con un ciclo vital de tres a cuatro meses, es inviable tanto desde un punto de vista práctico como económico, pues sería un proceso muy largo y que requeriría instalaciones gigantescas para la cría de los ratones y la secuenciación de sus genomas. Una alternativa para generar ratones knockout de una manera eficiente radica en que, en lugar de introducir mutaciones al azar a lo largo de todo el genoma, esa mutagénesis se haga apuntando al gen concreto que se quiere modificar o suprimir.
Capecchi y Smithies investigaron la posibilidad de modificar un gen concreto en células de mamífero cultivadas in vitro. Para ello, aprovecharon una propiedad inherente de las células denominada recombinación homóloga. Esta desempeña un papel fundamental en la evolución de las especies, pues origina la variabilidad genética que resulta de combinar la información de cada una de nuestras parejas de cromosomas al entrecruzar fragmentos del ADN del cromosoma heredado de la madre y del heredado del padre.
La idea de Capecchi y Smithies consistía en preparar in vitro un fragmento de cromosoma en cuya posición central se encuentra la versión del gen que querían que reemplazara a la normal. Cuando introdujeron estos fragmentos de ADN en el interior de células de mamífero en cultivo vieron que era posible seleccionar aquellas células en las que, gracias al proceso de recombinación homóloga, el fragmento de ADN exógeno se había insertado en su sitio homólogo del genoma del ratón, reemplazando así a la secuencia endógena.
Simultáneamente, los trabajos de Evans se centraron en cómo conseguir estirpes de ratones mutantes a partir de embriones en los que introducía células modificadas genéticamente (por inserción de una secuencia exógena de ADN en una posición desconocida de sus cromosomas). La clave de los trabajos de Evans radicó en el uso de células madre embrionarias. De hecho, él fue uno de los pioneros en conocer las propiedades de estas células y en establecer las condiciones para su cultivo in vitro de manera indefinida. Estas células pueden originar todos los tejidos del cuerpo, y Evans comprobó que si los órganos sexuales del ratón resultante se formaban a partir de las células madre modificadas genéticamente, la mutación se propagaba a la siguiente generación, estableciéndose así una nueva estirpe de ratón mutante.
La combinación de los hallazgos de Evans y de los de Capecchi y Smithies hizo posible la publicación, en 1989, de los primeros ratones en los que un determinado gen había sido sustituido por una versión nula del mismo. Se trataba de los primeros ratones knockout.
Desde entonces, esta técnica se ha implantado en la práctica totalidad de los centros de investigación biomédica de todo el mundo que, a su vez, han tenido que adaptarse para albergar el cada vez mayor número de líneas de ratones knockout generadas.
En la actualidad, se dispone de versiones de ratones knockout de unos 10.000 genes, de las que unas 500 constituyen modelos animales de enfermedades humanas. Además, varios consorcios internacionales persiguen generar líneas de ratones knockout de los genes restantes y hacer que todas estén disponibles para la comunidad científica.
En cuanto a la utilidad de esta técnica para la investigación biomédica, ya se han mencionado los modelos animales que resultan de noquear los genes responsables de enfermedades hereditarias monogénicas como la fibrosis quística, muchas formas de hemofilia, la talasemia o la gran mayoría de las metabolopatías congénitas.
Sin embargo, esta técnica también ha servido para comprender el mecanismo patogénico de muchas enfermedades más complejas como el cáncer, la hipertensión, las enfermedades inflamatorias y autoinmunes y las neurodegenerativas, pues permite verificar o descartar el posible rol patogénico de un determinado gen. Así, por ejemplo, el ratón knockout de un gen que se sospecha que es un supresor de tumores tendría que mostrar una mayor susceptibilidad a desarrollar cáncer. En el caso de las enfermedades neurodegenerativas por priones como la de las vacas locas, se vio que el prión anómalo inoculado no transmitía la enfermedad a los ratones knockout carentes de la proteína del prión endógena, demostrando así que el prión infeccioso requiere la presencia de la proteína priónica normal a la que le transmite la capacidad patogénica. Además, la técnica ha experimentado mejoras sucesivas que permiten noquear un gen sólo en determinados tejidos o sólo a partir de una determinada edad, lo que ha multiplicado su potencial en investigación, tanto básica como aplicada.
José Lucas es investigador científico del CSIC en el Centro de Biología Molecular Severo Ochoa. http://www.cbm.uam.es/lineas/joselucas.htm

Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































